2015湖南雅礼中学二模理综试题及答案【理科综合】(4)
25.“太空粒子探测器”是由加速、偏转和收集三部分组成,其原理可简化如下:如图1所示,辐射状的加速电场区域边界为两个同心平行半圆弧面,圆心为O,外圆弧面AB的半径为L,电势为φ1,内圆弧面CD的半径为,电势为φ2。足够长的收集板MN平行边界ACDB,O到MN板的距离OP=L。假设太空中漂浮着质量为m,电量为q的带正电粒子,它们能均匀地吸附到AB圆弧面上,并被加速电场从静止开始加速,不计粒子间的相互作用和其它星球对粒子引力的影响。
(1)求粒子到达O点时速度的大小;
(2)如图2所示,在边界ACDB和收集板MN之间加一个半圆形匀强磁场,圆心为O,半径为L,方向垂直纸面向内,则发现从AB圆弧面收集到的粒子经O点进入磁场后有2/3能打到MN板上(不考虑过边界ACDB的粒子再次返回),求所加磁感应强度的大小;
(3)同上问,从AB圆弧面收集到的粒子经O点进入磁场后均不能到达收集板MN,求磁感应强度所满足的条件。试写出定量反映收集板MN上的收集效率η与磁感应强度B的关系的相关式子。
【答案】(1);(2);(3)。
【解析】
试题分析:(1)带电粒子在电场中加速时,由动能定理, (2分)
又U=φ1φ2 (2分)
所以: (1分)
(2)从AB圆弧面收集到的粒子有2/3能打到MN板上,刚好不能打到MN上的粒子从磁场中出来后速度方向与MN平行,则入射的方向与AB之间的夹角是60°,在磁场中运动的轨迹如图1,轨迹圆心角θ=60°(2分)
根据几何关系,粒子圆周运动的半径为r=L (2分)
由牛顿第二定律得: (1分)
联立解得: (1分)
(3)当沿OD方向的粒子刚好打到MN上,则由几何关系可知,(2分)
由牛顿第二定律得: (1分)
得:(1分),即(1分)
如图2,设粒子在磁场中运动圆弧对应的圆心角为α,由几何关系可知:(1分)
MN上的收集效率:(1分)
26.(14分)2014诺贝尔物理学奖授予开发蓝色发光二极管(LED)的三位科学家。长期以来,人们发明了红色及绿色LED,但三原色之一的蓝色LED却因在材料环节遇阻而被断言“难以在20世纪实现”。通过科学家漫长的实验,发现氮化镓晶体可以产生蓝色LED。资料显示:
①在室温下,氮化镓不溶于水、酸和碱。但在加热时氮化镓可溶于NaOH、H2SO4。
②氮化镓晶体的制备通常有两种方法:
a、通常以甲基镓Ga(CH3)3作为镓源,NH3作为氮源,在一定条件下反应制取氮化镓
b、通过甲基镓Ga(CH3)3分解产生单质镓,利用分解出的Ga与NH3的化学反应实现的,其的反应方程式为:2Ga(s)+2NH3(g)2GaN(s)+3H2(g)
③氢氧化镓Ga(OH)3与氢氧化铝类似,均有两性。
(1)下列有关镓及其化合物说法正确的是 。
A、第ⅢA族元素铟的性质与镓相似,氮化铟的化学式为In2N3
B、甲基镓与氨气反应时除生成氮化镓外,还生成CH4
C、元素周期表中镓的金属性比铝弱
D、镓位于元素周期表第四周期第ⅡA族
(2)三甲基镓在常温常压下为无色透明有毒液体。在空气中易氧化,在室温自燃,燃烧时产生金属氧化物白烟,其他元素均转化为稳定的氧化物。请写出三甲基镓在空气中自燃的化学方程式: 。
(3)工业上利用Ga与NH3合成氮化镓的反应方程式为:
2Ga(s)+2NH3(g)2GaN(s)+3H2(g) △H﹤0
①请写出上述反应的化学平衡常数表达式: 。
②在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是
A、①图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B、②图像中纵坐标可以为镓的转化率
C、③图像中纵坐标可以为化学反应速率
D、④图像中纵坐标可以为体系内混合气体平均相对分子质量
(4)工业上提纯镓的方法很多,其中以电解精炼法为多。具体原理如下:以待提纯的粗镓(内含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,通过某种特殊的离子迁移技术到达阴极并在阴极放电析出高纯镓。电解时阳极反应方程式为:Ga-3e-+4OH-=GaO2-+2H2O
①请写出在阳极生成的GaO2-通过离子迁移到阴极时,阴极电极反应方程式
。
②已知离子氧化性顺序为:Zn2+﹤Ga3+﹤Fe2+﹤Cu2+,请写出电解精炼镓时阳极泥的成分 。(填化学式)
【答案】
26.(14分,方程式3分,其它每空2分)
(1)B
(2)2Ga(CH3)3+12O2= Ga2O3+6CO2+9H2O
(3)①c3 (H2) /c2 (NH3) ②A (4)GaO2-+3e-+2H2O=Ga+4OH- Fe、Cu
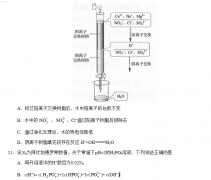
27.(14分)尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下:
请回答下列问题:
(1)操作I、II的名称分别是______、_______。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3kJ/mol、285.8kJ/mol
②H2O(l)=H2O(g)
写出CH4与水蒸气作用生产CO2和H2的热化学方程式: 。