2015武汉二月调考理综试题及答案【word版】
湖北省部分学校2015届高三毕业生(二)月调研考试理科综合试卷【完整版本试题最后一页下载】
命题:武汉二中 考试时间:2015年2月10日上午9:00—11:30
可能用到的相对原子质量H1 C 12 0 16 P 31 Cu 64
选择题共21小题,共126分
一、选择题:本题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题 目要求的。
7.化学与生产、生活、社会密切相关。下列说法中正确的是 ( )
A.甲烷、乙烯和苯在工业上都可通过石油分馏得到
B.钢铁在潮湿的空气中放置,易发生化学腐蚀而生锈
C.绿色化学的核心是从源头上消除工业生产对环境的污染
D.汽油、柴油和植物油都是碳氢化合物
8.下列方法或操作正确且能达到预期目的的是
9.根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.S2- xr、K+、Ca2+半径逐渐增大
D., 与得电子能力相同
10.下列电解质溶液的有关叙述正确的是 ( )
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的PH= 7
B.在含有BaS04沉淀的溶液中加人Na2S04固体,c(Ba2+)增大
C.含ImolKOH的溶液与lmolC02完全反应后,溶液中c(K+ ) = c (HCO 3- )
D.改变条件使醋酸溶液中的醋酸根离子浓度增大,溶液的pH值可能减小也可能增大
11.向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+ o:B(g)#2C(g)。 各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
下列说法不正确的是 ( )
A.10min内甲容器中反应的平均速率v (A) = 0. O25mol • L- 1 • min"1
B.由图可知:T1<T2,且该反应为放热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃起始时甲容器中充人0. 5molA、l. 5molB,平衡时C的浓度仍为1. 5mol • L_ 1
12.分子为C5H902Cl且分子中含有羧基和一个甲基的同分异构体的数目为(不考虑立体异构)( )
A. 4 B. 5 C. 6 D. 7
13.如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使 其在水中保持平衡,然后小心地向水槽中滴入浓CuS04溶液,一段时间后,下列有关杠杆的偏 向判断正确的是 ( )
A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A 端高B端低
D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A 端低B端高
26. (15分)硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的 Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
已知:
(1)步骤2中加热方式 (填“酒精灯直接加热”或“水浴加热”);必须在铁屑少量剩余时,进行热过滤,其原因是 。
(2)步骤3中包含的实验操作名称 。
(3)产品莫尔盐最后用 洗涤(填字母编号)。
a.蒸馏水 b.乙醇 c.滤液
∥∥.为测定硫酸亚铁铵(NH4)2SO4 • FeS04 • 6H20(式量:392)晶体纯度,某学生取mg硫酸亚铁铵样品配制成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20. 00mL硫酸亚铁铵溶液用0.1000mol • L—1的酸性KMn04溶液分三次进行滴定。
(乙)方案二:取20. 00mL硫酸亚铁铵溶液进行如下实验。
(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为 ,验证推测的方法为: 。
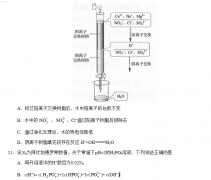
(丙)方案三:(通过NH广测定)实验设计图如下所示。取20. 00mL硫酸亚铁铵溶液进行该实验。
(2)①装置 (填“甲”或“乙”)较为合理,判断理由是 。量气管中最佳试剂是 (填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
a.水 b.饱和 NaHC03 溶液 c. CC14
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为
27. (13分)某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0. 1mol/L(此数值忽略水的电离及离子的水解)。
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用拍丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加人过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
IV、向Ⅲ中所得的溶液中加人BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2) Ⅲ中加人盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)另取lOOmL原溶液,加人足量的NaOH溶液,此过程中涉及的离子方程式为 。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为 g。(可能用到的相对原子质量:H1 O 16 Na23 Mg24 A127 Cu64 )
28. (15 分)
Ⅰ.纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)工业上常用方法2和方法3制取Cu