2015辽宁朝阳三校协作体开学联考理综试题及答案(3)
A. 电源(电动势约为2v,内阻不计)、滑动变阻器(最大阻值为10kΩ)
B. 电源(电动势约为2v,内阻不计)、滑动变阻器(最大阻值为2kΩ)
C . 电源(电动势约为6v,内阻不计)、滑动变阻器(最大阻值为2kΩ)
D. 电源(电动势约为6v,内阻不计)、滑动变阻器(最大阻值为10 kΩ)
24.如图,质量m为5kg的物块(看作质点)在外力F1和F2的作用下正沿某一水平面向右做匀速直线运动。已知F1大小为50N,方向斜向右上方,与水平面夹角,F2大小为30N,方向水平向左,物块的速度大小为11m/s.当物体运动到距初始位置距离时,撤掉F1,
(1) 求物块与水平地面之间的动摩擦因数
(2)求撤掉F1以后,物块在6S末距初始位置的距离。
25.如图,无限长的平行光滑金属轨道M、N,相距L,且水平放置;金属棒b和c之间通过绝缘轻弹簧相连,弹簧处于压缩状态,并锁定,压缩量为;整个装置放在磁感强度为B的匀强磁场中,磁场方向与轨道平面垂直.两棒开始静止,某一时刻,解除弹簧的锁定,两棒开始运动.已知两金属棒的质量mb=2mc=m,电阻Rb=RC=R,轨道的电阻不计.
(1)求当弹簧第一次恢复原长的过程中,通过导体棒某一横截面的电量.
(2)已知弹簧第一次恢复原长时,b棒速度大小为v,求此时c棒的加速度。
26. (14分) 请根据化学学科中的基本理论,回答下列问题
(1)纳米级的Cu2O可作为太阳光分解水的催化剂.火法还原CuO可制得Cu2O.已知: 1克C(s)燃烧全部生成CO时放出热量9.2kJ;Cu2O(s)与O2(g)反应的能量变化如右图所示;请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O.该反应的化学方程式为 ,当生成N211.2L(已换算为标准状况)时,可制备纳米级Cu2O的质量为
(3)某兴趣小组同学以纳米级Cu2O催化光解水蒸气并探究外界条件对化学平衡的影响.
①在体积均为1L,温度分别为T1、T2的A、B两密闭容器中都加入纳米级Cu2O并通人0.1mol水蒸气,发生反应:2H2O(g) 2H2(g)+O2 (g) △H=+484kJ•mol-1经测定A、B两容器在反应过程中发生如图所示变化,则A、B两容器反应的温度T1 T2 (填“<”、“=”或“>”),该过程中A容器至少需要吸收能量 kJ
②当该反应处于平衡状态时,下列既能增大反应速率,又能增大H2O(g)分解率的措施是(填序号) .
A.向平衡混合物中充入Ar B.升高反应的温度
C.增大反应体系的压强 D.向平衡混合物中充人O2
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L
27.(14分)某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 ,
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,而不在用盐酸,为什么
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是
(3)若滴定用掉c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是
28.(15分)某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为________________________________。
⑵.向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
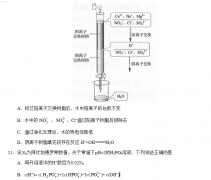
⑶将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是__________________。乙二酸分解的化学方程式为______________________。
⑷该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是____________________(用文字简单表述)。
⑸以上溶液中各离子的浓度由大到小的顺序为:______________(用离子符号表示);
29.(10分)甲图为小麦叶肉细胞在特定条件下的生理状态,乙图为小麦叶肉细胞内光合作用与呼吸作用之间物质变化关系图(G、X、Y表示物质,①~⑤表示过程),丙图为小麦叶片在不同光照强度下的光合作用速率。据图回答下列问题:
(1)甲图所示的生理状态下,产生ATP的场所有 (用字母表示)。