2014新余二模理综试题答案【理科综合】(3)
24.(14分)如图,质量m=2.0kg的物体在水平外力的作用下在水平面上运动,物体和水平面间的动摩擦因数μ=0.05,已知物体运动过程中的坐标与时间的关系为,g=10m/s2。根据以上条件求:
(1)t=10s时刻物体的位置坐标;
(2)t=10s时刻物体的速度的大小方向;
(3)t=10s时刻水平外力的大小(结果可以用根号表达)。
25.(18分) 如图所示,在xOy平面直角坐标系中,直线MN与y轴成30°角,P点的 坐标为(a ,O),在y轴与直线MN之间的区域内,存在垂直于xOy;平面向里磁感强度为B的匀强磁场。电子束以相同的速度V0从y轴上-2a≤y≤0的区间垂直于y轴和磁场方向射入磁场。己知从y轴上y = -2a点射入磁场的电子在磁场中的轨迹恰好经过O点,忽略电子间的相互作用,不计电子的重力。
(1)求电子的比荷;
(2)若在直角坐标系xOy的第一象限区域内,加上方向沿y轴正方向大小为E = B v0的匀强电场,在x = 3a处垂直于x轴放置一平面突光屏,与x轴交点为Q,求:从磁场中垂直于y轴射入电场的电子打到荧光屏上距Q点的最远距离。
26.(14分)一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)Ni(CO)4(g) 该反应的ΔH 0(选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH4= 。
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:
CO(g)+2H2(g)CH3OH(g)
①某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测
得c(CO)=0.2mol·L-1,则CO的转化率为 。
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 H2 CO CH3OH
浓度/(mol·L-1) 0.2 0.1 0.4
比较此时正、逆反应速率的大小:v正 v逆
(填“>”、“<”或“=”);若其他条件不变,在
T2℃反应10min后达到平衡,c(H2)=0.4 mol·L-1,
则该时间内反应速率:v(CH3OH) = ;
(4)金属氧化物被一氧化碳还原生成金属单质和二
氧化碳。下图是四种金属氧化物被一氧化碳还原时
lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。800℃
时,其中最易被还原的金属氧化物是 (填化学
式),该反应的平衡常数数值(K)等于 。
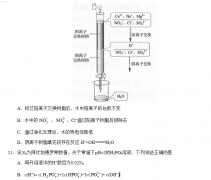
27.(14分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的
原理如下表所示。
湿法 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
干法 Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH= 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫为原料,以硫酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。
28.(15分)环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体。实验 室常用铬酸氧化环己醇制备,但铬酸较贵且污染环境。某化学兴趣尝试用中学化学更常见的次氯酸钠代替铬酸制备环己酮。有关物质信息、实验流程及实验装置如下:
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g (31℃)。
(1)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有 。
(2)加入饱和NaHSO3溶液时发生的主要反应是 (用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是
。